Os biofilmes são um coletivo de um ou mais tipos de microorganismos que podem crescer em muitas superfícies diferentes. Os microrganismos que formam biofilmes incluem bactérias, fungos e protistas.
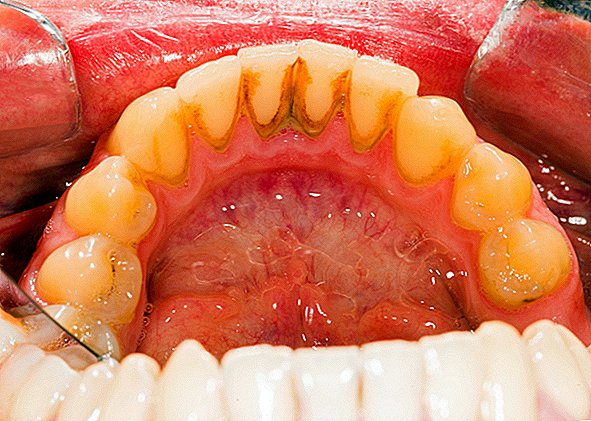
Um exemplo comum de uma placa dentária de biofilme, um acúmulo viscoso de bactérias que se forma na superfície dos dentes. A escória da lagoa é outro exemplo. Biofilmes foram encontrados crescendo em minerais e metais. Eles foram encontrados debaixo d'água, subterrâneos e acima do solo. Eles podem crescer em tecidos vegetais e animais e em dispositivos médicos implantados, como cateteres e marcapassos.
Cada uma dessas superfícies distintas tem uma característica definidora comum: elas estão molhadas. Esses ambientes são "periodicamente ou continuamente inundados com água", de acordo com um artigo de 2007 publicado na Microbe Magazine. Os biofilmes prosperam em superfícies úmidas ou molhadas.
Os biofilmes se estabelecem nesses ambientes há muito tempo. A evidência fóssil de biofilmes data de cerca de 3,25 bilhões de anos atrás, de acordo com um artigo de 2004 publicado na revista Nature Reviews Microbiology. Por exemplo, biofilmes foram encontrados nas rochas hidrotérmicas do fundo do mar de 3,2 bilhões de anos de idade do Pilbara Craton, na Austrália. Biofilmes semelhantes são encontrados em ambientes hidrotérmicos, como fontes termais e respiradouros do fundo do mar.

Formação de biofilme
A formação do biofilme começa quando microorganismos flutuantes, como bactérias, entram em contato com uma superfície apropriada e começam a criar raízes, por assim dizer. Essa primeira etapa de fixação ocorre quando os microrganismos produzem uma substância pegajosa conhecida como substância polimérica extracelular (EPS), de acordo com o Center for Biofilm Engineering da Montana State University. Um EPS é uma rede de açúcares, proteínas e ácidos nucleicos (como o DNA). Permite que os microrganismos em um biofilme se colem.
O anexo é seguido por um período de crescimento. Camadas adicionais de microorganismos e EPS se baseiam nas primeiras camadas. Por fim, eles criam uma estrutura 3D bulbosa e complexa, de acordo com o Center for Biofilm Engineering. Os canais de água cruzam os biofilmes e permitem a troca de nutrientes e resíduos, de acordo com o artigo da Microbe.
Várias condições ambientais ajudam a determinar até que ponto um biofilme cresce. Esses fatores também determinam se é composto de apenas algumas camadas de células ou significativamente mais. "Depende realmente do biofilme", disse Robin Gerlach, professor do departamento de engenharia química e biológica da Montana State University-Bozeman. Por exemplo, microorganismos que produzem uma grande quantidade de EPS podem se transformar em biofilmes bastante espessos, mesmo que não tenham acesso a muitos nutrientes, disse ele. Por outro lado, para microrganismos que dependem de oxigênio, a quantidade disponível pode limitar o quanto eles podem crescer. Outro fator ambiental é o conceito de "tensão de cisalhamento". "Se você tem um fluxo muito alto através de um biofilme, como em um riacho, o biofilme é geralmente bastante fino. Se você tem um biofilme em águas de fluxo lento, como em uma lagoa, pode se tornar muito espesso", explicou Gerlach.
Finalmente, as células dentro de um biofilme podem deixar a dobra e se estabelecer em uma nova superfície. Ou um grupo de células se rompe ou células individuais saem do biofilme e procuram um novo lar. Esse último processo é conhecido como "dispersão de semeadura", de acordo com o Center for Biofilm Engineering.
Por que formar um biofilme?
Para os microorganismos, viver como parte de um biofilme traz certas vantagens. "As comunidades de micróbios geralmente são mais resistentes ao estresse", disse Gerlach à Live Science. Os estressores potenciais incluem a falta de água, pH alto ou baixo ou a presença de substâncias tóxicas para microorganismos como antibióticos, antimicrobianos ou metais pesados.
Existem muitas explicações possíveis para a robustez dos biofilmes. Por exemplo, a cobertura fina de EPS pode atuar como uma barreira protetora. Pode ajudar a prevenir a desidratação ou agir como um escudo contra a luz ultravioleta (UV). Além disso, substâncias nocivas, como antimicrobianos, alvejantes ou metais, são ligadas ou neutralizadas quando entram em contato com o EPS. Assim, eles são diluídos em concentrações que não são letais bem antes de atingirem várias células profundas no biofilme, de acordo com um artigo de 2004 na Nature Reviews Microbiology.
Ainda assim, é possível que certos antibióticos penetrem no EPS e passem pelas camadas de um biofilme. Aqui, outro mecanismo de proteção pode entrar em jogo: a presença de bactérias fisiologicamente dormentes. Para funcionar bem, todos os antibióticos requerem algum nível de atividade celular. Portanto, se as bactérias estão fisiologicamente dormentes, não há muito para um antibiótico interromper.
Outro modo de proteção contra antibióticos é a presença de células bacterianas especiais conhecidas como "persistentes". Essas bactérias não se dividem e são resistentes a muitos antibióticos. De acordo com um artigo de 2010 publicado na revista Cold Spring Harbor Perspectives in Biology, "persiste" funciona produzindo substâncias que bloqueiam os alvos dos antibióticos.
Em geral, os microorganismos que vivem juntos como biofilme se beneficiam da presença de seus vários membros da comunidade. Gerlach citou o exemplo de microorganismos autotróficos e heterotróficos que vivem juntos em biofilmes. Autotróficos, como bactérias ou algas fotossintéticas, são capazes de produzir seus próprios alimentos na forma de material orgânico (contendo carbono), enquanto heterotróficos não podem produzir seus próprios alimentos e requerem fontes externas de carbono. "Nessas comunidades multi-organizacionais, elas geralmente cruzam a alimentação", disse ele.
Biofilmes e nós
Dada a vasta gama de ambientes em que encontramos biofilmes, não é surpresa que eles afetem muitos aspectos da vida humana. Abaixo estão alguns exemplos.

Saúde e doença
À medida que a pesquisa progrediu ao longo dos anos, os biofilmes - bacterianos e fúngicos - foram implicados em várias condições de saúde. Em um pedido de subsídio de 2002, os Institutos Nacionais de Saúde (NIH) observaram que os biofilmes representavam "mais de 80% das infecções microbianas no organismo".
Os biofilmes podem crescer em dispositivos médicos implantados, como válvulas cardíacas protéticas, próteses articulares, cateteres e marcapassos. Por sua vez, isso leva a infecções. O fenômeno foi observado pela primeira vez na década de 1980, quando biofilmes bacterianos foram encontrados em cateteres e marca-passos intravenosos. Sabe-se também que os biofilmes bacterianos causam endocardite infecciosa e pneumonia naqueles com fibrose cística, de acordo com o artigo de 2004 da Nature Reviews Microbiology, entre outras infecções.
"A razão pela qual a formação de biofilme é uma grande causa de preocupação é que, dentro de um biofilme, as bactérias são mais resistentes a antibióticos e outros desinfetantes importantes que você pode usar para controlá-los", disse AC Matin, professor de microbiologia e imunologia em Stanford. Universidade. De fato, quando comparadas às bactérias que flutuam livremente, as que crescem como biofilme podem ser 1.500 vezes mais resistentes a antibióticos e outros agentes biológicos e químicos, de acordo com o artigo da Microbe. Matin descreveu a resistência ao biofilme combinada com o aumento geral da resistência a antibióticos entre bactérias como um "golpe duplo" e um grande desafio para o tratamento de infecções.
Os biofilmes fúngicos também podem causar infecções pelo crescimento em dispositivos implantados. Espécies de leveduras, como os membros do gênero Candida crescer em implantes mamários, marcapassos e válvulas cardíacas protéticas, de acordo com um artigo de 2014 publicado na revista Cold Spring Harbor Perspectives in Medicine. Candida as espécies também crescem nos tecidos do corpo humano, levando a doenças como vaginite (inflamação da vagina) e candidíase orofaríngea (uma infecção por fungos que se desenvolve na boca ou na garganta). No entanto, os autores observam que a resistência aos medicamentos não foi demonstrada nesses casos.
Biorremediação
Às vezes, os biofilmes são úteis. "Biorremediação, em geral, é o uso de organismos vivos ou de seus produtos - por exemplo, enzimas - para tratar ou degradar compostos nocivos", afirmou Gerlach. Ele observou que os biofilmes são usados no tratamento de águas residuais, contaminantes de metais pesados como cromato, explosivos como TNT e substâncias radioativas como urânio. "Os micróbios podem degradá-los ou alterar sua mobilidade ou seu estado tóxico e, portanto, torná-los menos prejudiciais ao meio ambiente e aos seres humanos", disse ele.
A nitrificação usando biofilmes é uma forma de tratamento de águas residuais. Durante a nitrificação, a amônia é convertida em nitritos e nitratos por oxidação. Isso pode ser feito por bactérias autotróficas, que crescem como biofilmes em superfícies plásticas, de acordo com um artigo de 2013 publicado na revista Water Research. Essas superfícies de plástico têm apenas alguns centímetros de tamanho e são distribuídas por toda a água.
O TNT explosivo (2,4,6-Trinitrotolueno) é considerado poluente no solo, nas águas superficiais e subterrâneas. A estrutura química do TNT consiste em benzeno (um anel aromático hexagonal feito de seis átomos de carbono) ligado a três grupos nitro (NO2) e um grupo metil (CH3) Os microorganismos degradam o TNT por redução, de acordo com um artigo de 2007 publicado na revista Applied and Environmental Microbiology. A maioria dos microorganismos reduz os três grupos nitro, enquanto alguns atacam o anel aromático. Os pesquisadores - Ayrat Ziganshin, Robin Gerlach e colegas - descobriram que a cepa do fermento Yarrowia lipolytica foi capaz de degradar o TNT pelos dois métodos, embora principalmente atacando o anel aromático.
Células de combustível microbianas
As células de combustível microbiano usam bactérias para converter resíduos orgânicos em eletricidade. Os micróbios vivem na superfície de um eletrodo e transferem elétrons para ele, criando uma corrente, disse Gerlach. Um artigo de 2011 publicado na Illumin, uma revista on-line da Universidade do Sul da Califórnia, observa que bactérias que alimentam células de combustível microbianas decompõem alimentos e resíduos corporais. Isso fornece uma fonte de energia de baixo custo e energia limpa e sustentável.
Pesquisa em andamento
Nosso mundo está repleto de biofilmes. De fato, em meados do século XX, mais bactérias foram encontradas nas superfícies internas de recipientes contendo culturas bacterianas do que flutuando livremente na própria cultura líquida, de acordo com o artigo de 2004 na Nature Reviews Microbiology. Compreender essas estruturas microbianas complexas é uma área ativa de pesquisa.
"Os biofilmes são comunidades incríveis. Algumas pessoas os compararam a organismos multicelulares porque há muita interação entre células únicas", disse Gerlach. "Continuamos aprendendo sobre eles, e continuamos aprendendo sobre como controlá-los melhor; tanto por redução de prejuízo, como no campo da medicina, quanto por benefício aumentado, como na biorremediação. Não vamos ficar sem questões interessantes nessa área ".